Na madrugada do 29 de decembro, NEJM publicou en liña un novo estudo clínico de fase III do novo coronavirus chinés VV116.Os resultados mostraron que VV116 non foi peor que Paxlovid (nematovir/ritonavir) en termos de duración da recuperación clínica e tivo menos eventos adversos.
Fonte da imaxe: NEJM
Tempo medio de recuperación 4 días, taxa de eventos adversos 67,4%
O VV116 é un fármaco nucleósido oral contra o novo coronavirus (SARS-CoV-2) desenvolvido en colaboración con Junsit e Wang Shan Wang Shui, e é un inhibidor de RdRp xunto co remdesivir de Gilead, o molnupiravir de Merck Sharp & Dohme e a azelvudina de Real Biologics.
En 2021, un ensaio clínico de fase II de VV116 completouse en Uzbekistán.Os resultados do estudo mostraron que o grupo VV116 podería mellorar mellor os síntomas clínicos e reducir significativamente o risco de progresión á forma crítica e morte en comparación co grupo control.En base aos resultados positivos deste ensaio, VV116 foi aprobado en Uzbekistán para o tratamento de pacientes con COVID-19 de moderado a grave, e converteuse no primeiro novo fármaco coronario oral aprobado para a súa comercialización no exterior en China [1].
Este ensaio clínico de fase III[2] (NCT05341609), dirixido polo profesor Zhao Ren do Hospital Ruijin de Shanghai, o profesor Gaoyuan do Hospital Renji de Shanghai e o académico Ning Guang do Hospital Ruijin de Xangai, completouse durante o brote causado pola variante Omicron ( B.1.1.529) de marzo a maio en Shanghái, co obxectivo de avaliar a eficacia e seguridade de VV116 fronte a Paxlovid para o tratamento precoz de pacientes con COVID-19 leve a moderado.O obxectivo era avaliar a eficacia e seguridade de VV116 fronte a Paxlovid para o tratamento precoz de pacientes con COVID-19 de leve a moderado.
Fonte da imaxe: Referencia 2
Entre o 4 de abril e o 2 de maio de 2022 realizouse un ensaio controlado aleatorizado, multicéntrico, cegado por observadores de 822 pacientes adultos con Covid-19 con alto risco de progresión e con síntomas leves a moderados para avaliar a elegibilidade dos participantes de sete hospitais de Shanghai. China.Finalmente, 771 participantes recibiron VV116 (384, 600 mg cada 12 horas o día 1 e 300 mg cada 12 horas os días 2-5) ou Paxovid (387, 300 mg de nimatuvir + 100 mg de ritonavir cada 12 horas durante 5 días) como medicación oral.
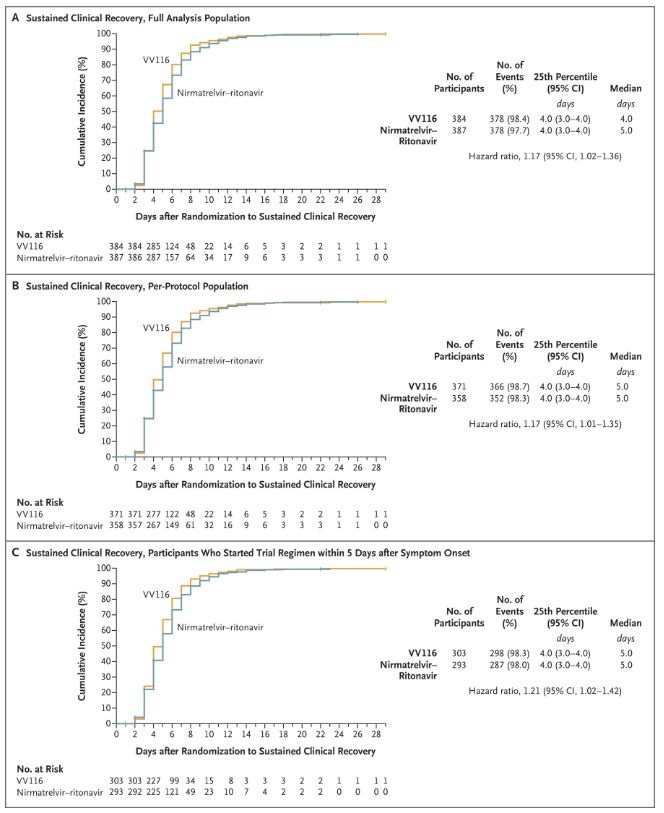
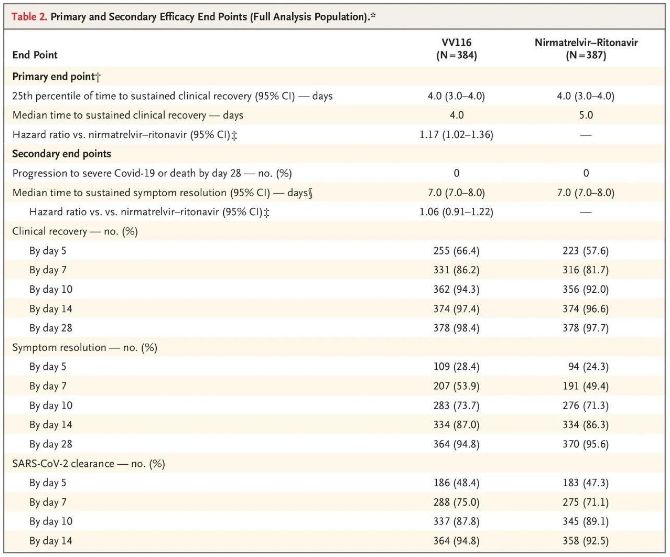
Os resultados deste estudo clínico mostraron que o tratamento precoz con VV116 para COVID-19 leve a moderado cumpriu o criterio final principal (tempo ata a recuperación clínica sostida) previsto polo protocolo clínico: o tempo medio ata a recuperación clínica foi de 4 días no grupo VV116 e de 5 días. días no grupo Paxlovid (cociente de perigo, 1,17; IC 95%, 1,02 a 1,36; límite inferior. > 0,8).
Manter o tempo de recuperación clínica
Criterios de valoración de eficacia primarios e secundarios (análise exhaustiva da poboación)
Fonte da imaxe: Referencia 2
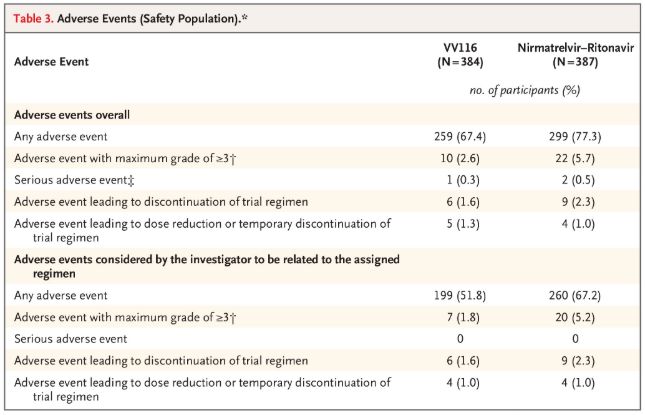
En termos de seguridade, os participantes que recibiron VV116 informaron menos eventos adversos (67,4 %) que os que recibiron Paxlovid (77,3 %) no seguimento de 28 días, e a incidencia de eventos adversos de grao 3/4 foi menor para VV116 (2,6 %). ) que para Paxlovid (5,7%).
Eventos adversos (persoas seguras)
Fonte da imaxe: Referencia 2
Controversias e preguntas
O 23 de maio de 2022, Juniper revelou que o estudo clínico de rexistro de Fase III de VV116 versus PAXLOVID para o tratamento precoz da COVID-19 leve a moderada (NCT05341609) cumpriu o seu principal criterio de valoración.
Fonte da imaxe: Referencia 1
Nun momento no que faltaban os detalles do ensaio, a polémica ao redor do estudo Fase III era dobre: en primeiro lugar, era un estudo simple cego e, a falta dun control con placebo, temíase que fose difícil de xulgar. a droga completamente obxectivamente;en segundo lugar, houbo preguntas sobre os efectos clínicos.
Os criterios de inclusión clínica de Juniper son (i) resultados positivos para a nova proba da coroa, (ii) un ou máis síntomas leves ou moderados de COVID-19 e (iii) pacientes con alto risco de sufrir COVID-19 grave, incluída a morte.Non obstante, o único criterio clínico primario é o "tempo para unha recuperación clínica sostida".
Xusto antes do anuncio, o 14 de maio, Juniper revisou os criterios de valoración clínicos eliminando un dos criterios de valoración clínicos primarios, "proporción de conversións a enfermidade grave ou morte" [3].
Fonte da imaxe: Referencia 1
Estes dous puntos principais de discusión tamén foron abordados especificamente no estudo publicado.
Debido ao brote repentino de Omicron, a produción de comprimidos de placebo para Paxlovid non se completara antes do inicio do ensaio e, polo tanto, os investigadores non puideron realizar este ensaio utilizando un deseño dobre cego e simulado.En canto ao aspecto simple cego do ensaio clínico, Juniper dixo que o protocolo levouse a cabo tras a comunicación coas autoridades reguladoras e que o deseño simple cego significa que nin o investigador (incluído o avaliador do punto final do estudo) nin o patrocinador saberán. a asignación específica de fármacos terapéuticos ata que se bloquee a base de datos final ao final do estudo.
Ata o momento da análise final, ningún dos participantes no ensaio experimentara morte ou progresión a un evento grave de Covid-19, polo que non se poden extraer conclusións sobre a eficacia do VV116 na prevención da progresión a Covid-19 grave ou crítico. ou morte.Os datos indicaron que o tempo medio estimado desde a aleatorización ata a regresión sostida dos síntomas obxectivo relacionados co Covid-19 foi de 7 días (IC 95%, 7 a 8) en ambos os grupos (cociente de perigo, 1,06; IC 95%, 0,91 a 1,22) [2].Non é difícil explicar por que se eliminou o criterio final principal de "taxa de conversión a enfermidade grave ou morte", que se estableceu orixinalmente antes do final do ensaio.
O 18 de maio de 2022, a revista Emerging Microbes & Infections publicou os resultados do primeiro ensaio clínico de VV116 en pacientes infectados coa variante Omicron [4], un estudo de cohorte aberto e prospectivo con 136 pacientes confirmados.
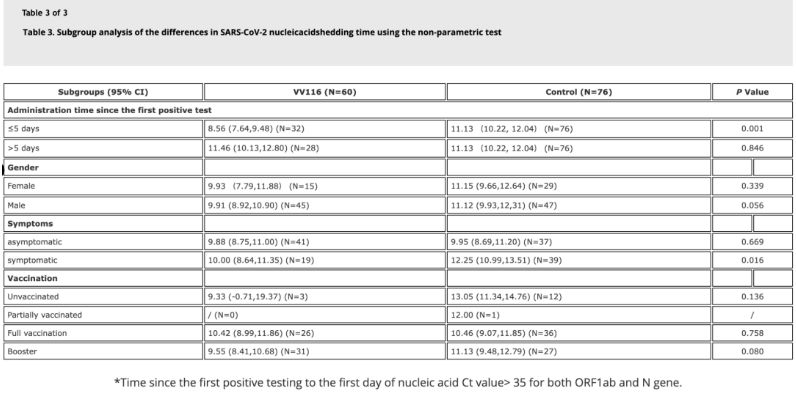
Os datos do estudo mostraron que os pacientes con infección por Omicron que usaron VV116 dentro dos 5 días posteriores á súa primeira proba de ácido nucleico positiva tiveron un tempo de regresión do ácido nucleico de 8,56 días, menos que os 11,13 días do grupo control.A administración de VV116 a pacientes sintomáticos no período de tempo deste estudo (2-10 días da primeira proba de ácido nucleico positiva) reduciu o tempo ata a regresión do ácido nucleico en todos os pacientes.En canto á seguridade do medicamento, non se observaron efectos adversos graves no grupo de tratamento con VV116.
Fonte da imaxe: Referencia 4
Hai tres ensaios clínicos en curso sobre VV116, dous dos cales son estudos de fase III sobre COVID-19 leve a moderado (NCT05242042, NCT05582629).O outro ensaio para COVID-19 de moderada a grave é un estudo clínico internacional multicéntrico, aleatorizado e dobre cego de fase III (NCT05279235) para avaliar a eficacia e a seguridade do VV116 en comparación co tratamento estándar.Segundo o anuncio de Juniper, o primeiro paciente foi inscrito e dosificado en marzo de 2022.
Fonte da imaxe:clinicaltrials.gov
Referencias:
[1]Junshi Biotech: Anuncio sobre o punto final principal do estudo clínico rexistrado de Fase III de VV116 versus PAXLOVID para o tratamento precoz de COVID-19 leve a moderado
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] Ensi Ma, Jingwen Ai , Yi Zhang, Jianming Zheng, Xiaogang Gao, Junming Xu, Hao Yin, Zhiren Fu, Hao Xing, Li Li, Liying Sun, Heyu Huang, Quanbao Zhang, Linlin Xu, Yanting Jin, Rui Chen, Guoyue Lv, Zhijun Zhu, Wenhong Zhang, Zhengxin Wang.(2022) Perfil de infeccións por Omicron e estado de vacinación entre 1881 receptores de transplante de fígado: unha cohorte retrospectiva multicéntrica.Emerging Microbes & Infections 11:1, páxinas 2636-2644.
Hora de publicación: 06-xan-2023
 中文网站
中文网站